TEMAS
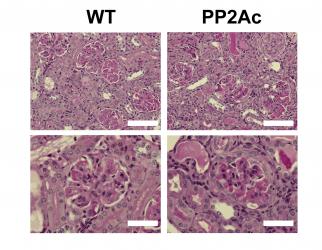
Papel de la fosfatasa PP2A en el control de la inflamación
Estudios iniciales encontraron que la subunidad catalítica de la
fosfatasa de serinas y treoninas PP2A (PP2Ac) está sobreexpresada en células T
de pacientes con lupus eritematoso generalizado (LEG). Con el fin de investigar
si dicho defecto contribuye al desarrollo de LEG, creamos un ratón transgénico
que expresa niveles anormalmente altos de PP2Ac en células T. El ratón
transgénico demostró tener mayor susceptibilidad al desarrollo de
glomérulonefritis inducida por complejos inmunes (Crispín et al., J Immunol 2012).
En estudios posteriores mostramos que el mecanismo molecular a través del cual
el incremento en los niveles de PP2Ac genera susceptibilidad a la nefritis es
la facilitación epigenética de la transcripción de genes pro-inflamatorios como
la Il17a a través de un mecanismo
dependiente de IRF4 (Apostolidis et al.,
J Biol Chem 2013). PP2A
también juega un papel esencial en la biología de las células T reguladoras ya
que su deleción específica en células FoxP3+ anula su capacidad
supresora y causa una enfermedad autoinmune sistémica grave (Apostolidis et al., Nat Immunol 2016).
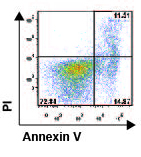
Mecanismos que limitan la duración de la respuesta inmune
Con el fin de entender con mayor detalle la biología de PP2A y su
contribución al desarrollo de autoinmunidad, realizamos un estudio para
identificar qué subunidades reguladoras se expresan en células T. Encontramos
que B55ß se induce en células T durante estados de baja
concentración de citocinas y que su presencia es necesaria y suficiente para la
muerte celular inducida por privación de IL-2 (Crispin et al., Proc Natl Acad Sci
USA 2011). El análisis de la cinética de expresión de B55ß en células T de pacientes con LEG identificó a
un subgrupo de pacientes cuyas células T son resistentes a la inducción de
apoptosis por privación de IL-2. B55ß no se
expresa en esos pacientes, lo que sugiere que fallas en la regulación de esta
molécula podrían contribuir a la autoinmunidad al fallar la eliminación de
clonas de células T activadas.
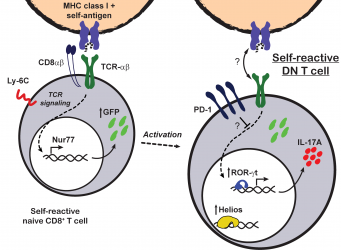
Desaparición de la molécula CD8 como mecanismo de tolerancia periférica
Los pacientes y los ratones con lupus frecuentemente tienen cantidades
anormalmente altas de una subpoblaci√≥n de c√©lulas T (TCR-őĪ√ü+) que carece de las mol√©culas coreceptoras CD4 y CD8. Estas c√©lulas se
han denominado dobles negativas (DN). Nuestros estudios iniciales mostraron que
las células T DN son capaces de producir grandes cantidades de citocinas
pro-inflamatorias (e.g. IL-17, IFN-gamma) y que son
abundantes en los infiltrados inflamatorios de ri√Īones de pacientes con
nefritis l√ļpica (Crisp√≠n et al., J Immunol 2008). Estudios
posteriores encaminados a investigar el origen de estas células encontraron que
provienen de células CD8+ que pierden la expresión de CD8 tras la
activación (Crispín et al., J Immunol 2009). Con el fin de
investigar con mayor detalle los factores que gobiernan la conversión de
células CD8 a DN, establecimos un sistema in vivo usando ratones transgénicos.
Demostramos que las células CD8+ mantienen la expresión del
correceptor CD8 cuando son activadas en el contexto de una infección. En
cambio, cuándo éstas se exponen a antígenos presentados como moléculas propias,
sufren una inactivación funcional que se mantiene por la desaparición de CD8 y
la expresión de niveles altos de moléculas inhibitorias como PD-1 y Helios (Rodríguez-Rodríguez
et al., J Immunol 2015). Este proceso sucede en ratones normales en
forma continua ya que la subpoblación de células DN PD-1+ está
formada por células autoreactivas que solían ser CD8+ (Rodríguez-Rodríguez
et al., Eur J Immunol 2016).

Efectos biológicos de variantes genéticas asociadas a enfermedades autoinmunes
Estudios de asociaci√≥n gen√©tica (GWAS, genome-wide association studies), han detectado m√ļltiples genes que
confieren riesgo de desarrollar enfermedades complejas. Esos an√°lisis se basan
en la segregación desequilibrada de polimorfismos comunes (SNPs, del inglés single nucleotide polymorphisms) entre
pacientes y personas sanas. Aproximadamente 30 loci han sido asociados a la
presencia de lupus. Una de las asociaciones m√°s fuertes se encuentra en el gen ITGAM, que codifica para la cadena alfa
de la molécula de adhesión Mac-1. El
alelo de ITGAM asociado a lupus provoca una mutación (R77H). Para identificar
los efectos que causa la sustitución R77H, generamos líneas celulares que
expresan la variante normal y la variante de riesgo. En estudios in vitro
mostramos que la variante R77H disminuye la capacidad de Mac-1 de unirse a sus ligandos
(iC3b e ICAM-1), específicamente bajo flujo constante (Rosetti et al,
J Immunol 2012). En estudios
subsecuentes disecamos el mecanismo molecular que subyace al defecto: la
variante asociada a lupus (R77H) es incapaz de formar enlaces de captura:
‚Äúcatch bonds‚ÄĚ (Rosetti et al, Cell Reports 2015). Para estudiar los efectos in vivo de un
defecto funcional de Mac-1, utilizamos ratones genéticamente modificados que
expresan receptores FcgRIIA humano en presencia o
ausencia de Mac-1. La inyección intravenosa de suero de pacientes con LEG con
altas concentraciones de complejos inmunes, causan el depósito de éstos en la
vasculatura glomerular. Este depósito ocasionó el desarrollo de glomerulonefritis
√ļnicamente en ratones deficientes de Mac-1. La ausencia de Mac-1 se asoci√≥ con un
gran infiltrado de neutrófilos. Basados en esos trabajos, hemos propuesto que Mac-1
es una molécula clave que modula la respuesta de neutrófilos a complejos
inmunes. Ausencia de Mac-1 o defectos en su función se asocian a una mayor activación
de neutr√≥filos ante complejos inmunes y al desarrollo de da√Īo tisular (Rosetti et al, J Immunol 2012).

Papel del Factor de Transcripción Helios como un Nuevo Inmunosupresor Asociado a Cáncer y Estrategias para Inhibirlo
Este proyecto se deriva de dos
observaciones hechas por mi grupo de trabajo: (1) las células T CD8+ se
inactivan cuando se enfrentan a su antígeno expresado como antígeno propio y
esa inactivación involucra la expresión del factor de transcripción Helios
(IKZF2); (2) un fenómeno análogo se observa en las células CD8 que infiltran
tumores malignos. En base a ello postulamos la hipótesis de que la inducción de
Helios, en el microambiente tumoral, frena la capacidad del sistema
inmunológico de eliminar células cancerosas. Por lo tanto, la inhibición de
Helios representa una oportunidad terapéutica novedosa en el contexto del
c√°ncer. Los objetivos de este proyecto son probar si Helios limita la capacidad
funcional de las células T, identificar el mecanismo a través del que lo hace y
descubrir inhibidores de su inducción. Link: https://www.youtube.com/watch?v=umx6mkhnzvM&ab_channel=LabInmunopatologia

La Oveja Eléctrica - Trailer Temporada 18
Participaci√≥n del doctor Jose Carlos Crisp√≠n Acu√Īa en el programa La oveja el√©ctrica, el programa de difusi√≥n de las ciencias m√°s destacado en M√©xico y Am√©rica Latina.
Link: https://www.youtube.com/watch?v=Xio0eGjshFk&ab_channel=ConahcytM%C3%A9xico
